叶盛教授在清华大学师从我国著名结构生物学家饶子和院士攻读直博以来,已从事结构生物学研究近二十年。在美国哥伦比亚大学从事博士后工作期间,叶盛的合作教授为美国科学院院士Wayne Hendrickson教授,他也是结构生物学领域一些重要研究方法的奠基人,这段科研经历令叶盛在结构生物学的理论和实践方面都得到了进一步的提升。
回国加入中科院生物物理所之后,叶盛的研究组即确立了疾病的分子病理机制研究方向,具体的研究手段以结构生物学方法为主,辅以生物化学、细胞生物学等其他方法。通过对病理机制中关键蛋白质的结构和功能研究,力争阐明病理机制中的若干环节,并以关键蛋白质为基础,设计寻找能够与之结合并起到药物作用的化合物分子,尝试初步的药物研发。在这个研究方向上,叶盛的研究组已经取得了以下研究成果:
1)在外源性疾病方面,围绕病毒侵染过程中的融合核心,对现有药物进行了改造并设计了新的抗侵染药物。在艾滋病的治疗方面,已经存在上市销售的抗侵染药物T20,其针对的就是病毒侵染细胞过程中形成的六螺旋融合核心。我们通过结构研究,提出了对T20进行逐步改造的方案,先后发表了多篇论文,使新药物的药效比T20提高了一倍,并且成功规避了T20的一些弱点。在中东呼吸综合征(MERS)出现以后,我们在世界上率先解析得到了MERS的融合核心结构,并在此基础上设计改造了一段多肽,具备极强的抗病毒侵染的能力。这也是世界上首个针对MERS的潜在药物。该成果发表在了《Nature Communications》上。
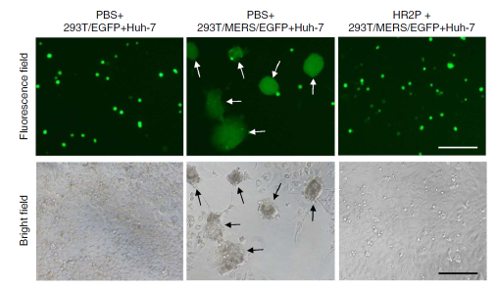
多肽HR2P能够有效抑制融合核心介导的细胞融合
2)在内源性疾病方面,围绕癌细胞转移的分子机制展开了一系列研究。癌症转移是癌症治疗中一个非常棘手的严重问题,经过手术治疗或放化疗已经治愈的癌症病人,仍要时时担心转移所带来的次发性癌症风险。据世卫组织统计,死于癌症的病人当中有90%是死于次发性癌症,突显了抑制癌症转移的迫切性,以及当前在相关领域的知识匮乏。癌细胞转移类似于细胞迁移过程,涉及以整合素为核心的一系列生理事件。我们围绕整合素的激活问题展开了研究,对相关激活因子Talin等蛋白质进行结构与功能研究,阐明了Talin解除自抑制状态的分子机理。该结果以封面文章的形式发表在了《Cell Research》上。

《Cell Research》第22卷(2012年)第11期封面文章
3)翻译后修饰机制研究与癌症的表观遗传因素。有越来越多的证据表明,癌症等重大疾病可能不会直接表现为基因或蛋白层面的突变,而会以蛋白质表达水平的异常或翻译后修饰状态的异常为主要特征。了解这些翻译后修饰类型的分子机制,不仅有助于深入认识这些修饰的机理,并且可能寻找到新的疾病治疗靶点。2012年至2016年期间,叶盛主持了“973”项目课题“UPS等修饰分子机制的结构研究”,深入开展了泛素化、类泛素化、糖基化、磷酸化等多种翻译后修饰的分子机制的研究。特别是在Neddylation等类泛素化修饰方面,有了一系列新的发现。此外,我们还在世界上首次鉴定了细胞核内对组蛋白的生物素化修饰进行去除的催化酶,大大推进了人们对于生物素化修饰的认识程度,并且建立了该种修饰与表观遗传之间的关系。相关研究工作正在结果总结与文章写作中。
2019年4月加入北航大数据精准医疗高精尖中心以来,叶盛着手建立了疾病分子病理机制的研究组,在延续之前研究工作的同时,与中心的多组学研究团队通力合作,针对在多组学研究中发现的关键致病蛋白质或致病基因的表达产物进行结构和功能研究,以期在微观层面上揭示疾病的分子病理机制并进行后续的药物研发。
此外,叶盛教授的研究组未来还将在蛋白质设计方向上发力。随着蛋白质结构数据的快速积累,我们已经不满足于只是观察天然蛋白质,或对天然蛋白质进行个别残基突变的局部改造。合成生物学的迅猛发展需要越来越多的非天然蛋白质来完成人类设计出来的独特催化功能或结构功能。此类全新蛋白质只能通过人工设计的方法来获得,这就需要计算机技术与结构生物学知识的深度融合。叶盛教授将利用他本人在结构生物学领域的丰富经验,结合北航在人工智能等计算机科学领域的技术优势,实现国内在蛋白质设计领域的新突破。
